?
Какое определение наиболее полно характеризует понятие «фаза термодинамической системы»
– Часть термодинамической системы, ограниченная видимой поверхностью раздела.
– Гомогенная часть термодинамической системы.
+ Совокупность гомогенных частей системы, одинаковых во всех точках по составу и свойствам и ограниченных от других частей системы поверхностью раздела.
– Одно из веществ, входящих в состав термодинамической системы, взятое в определенном агрегатном состоянии.
?
Какое определение наиболее полно соответствует понятию «компоненты термодинамической системы»
– Вещества, которые могут быть выделены из системы и существовать вне нее.
+ Индивидуальные химические вещества, наименьшее число которых необходимо и достаточно для образования всех фаз равновесной системы.
– Вещества с неограниченной взаимной растворимостью в жидкой или твердой фазах.
– Индивидуальные химические вещества, образующие термодинамическую систему в результате химического взаимодействия друг с другом.
?
Что такое степень свободы или вариативность термодинамической системы
– Это число параметров системы, связанных между собой какой – либо математической зависимостью.
+ Это число параметров системы, которые можно менять независимо друг от друга, не меняя при этом числа и вида фаз системы.
– Это число независимых параметров системы.
– Это минимальное число веществ, необходимое и достаточное для образования всех фаз системы.
?
Какое из определений соответствует понятию диаграмма состояния
– Диаграмма состояния, на которой изображены разные фазы: жидкая, газообразная, все аллотропные модификации вещества в твердом агрегатном состоянии.
+ Графическое выражение зависимостей между значениями переменных, определяющих состояние системы (объем, давление, температура, концентрация веществ и пр.).
– Графическое выражение зависимости между составом системы и температурой или давлением.
– Диаграмма, на которой показана взаимная растворимость компонентов системы.
?
Какое из определений соответствует понятию фазовая диаграмма
+ Диаграмма состояния, на которой изображены разные фазы: жидкая, газообразная, все аллотропные модификации вещества в твердом агрегатном состоянии.
– Графическое выражение зависимостей между значениями переменных, определяющих состояние системы (объем, давление, температура, концентрация веществ и пр.).
– Графическое выражение зависимости между составом системы и температурой или давлением.
– Диаграмма, на которой показана взаимная растворимость компонентов системы.
?
Как называются смеси жидких веществ с постоянной температурой кипения
– Идеальные.
– Азеотропные.
– Гомогенные.
– Изоморфные.
?
Какие растворы НЕ могут быть разделены путем перегонки на чистые компоненты
– Имеющие достаточно большую разницу в температурах кипения компонентов.
– Растворы, содержащие компоненты, отличающиеся по природе и полярности связей в молекулах.
+ Растворы, обладающие точками экстремума на диаграммах «температура кипения – состав».
– Не имеющих экстремумов на диаграммах «температура кипения – состав».
?
Каким условиям отвечает равновесие термодинамической системы
– Одинаковое агрегатное состояние всех компонентов системы.
+ Равенство химических потенциалов каждого компонента во всех фазах.
– Отсутствие видимых процессов или явлений.
– Минимальное значение энтропии.
?
Для какой термодинамической системы правило фаз Гиббса будет иметь следующий вид: V усл. = С – φ + 1
+ Температура или давление – постоянная величина.
– Концентрации компонентов одинаковы.
– Компоненты системы находятся в тонкодисперсном состоянии.
– Концентрации компонентов одинаковы во всех фазах.
?
Для какой термодинамической системы правило фаз Гиббса будет иметь следующий вид: Vусл. = С – φ + 3
– Температура или давление – постоянная величина.
– Концентрации компонентов одинаковы.
+ Компоненты системы находятся в тонкодисперсном состоянии.
– Концентрации компонентов одинаковы во всех фазах.
?
Каким технологическим приемом можно сместить положение азеотропной точки
+ Изменить давление, при котором ведется перегонка.
– Изменить температуру перегонки.
– Изменить аппаратурное оформление процесса.
– Изменить состав перегоняемой жидкой смеси.
?
Какова причина отклонения реальных растворов от идеальности
– Подчинение закону Рауля.
– Подчинение объема смеси закону аддитивности.
+ Наличие взаимодействий между компонентами раствора.
– Отсутствие водородных связей между компонентами раствора.
?
Почему при кипении реальных растворов состав равновесного пара находится экспериментально, а не рассчитывается по уравнению: 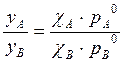
+ Давление паров над реальным раствором может иметь существенные отклонения от рассчитанного по закону Рауля.
– Состав равновесного пара непрерывно меняется по мере отгонки легколетучего компонента.
– Так как неизвестны давления насыщенных паров компонентов при конкретно заданной температуре.
– Приведенное уравнение пригодно только для идеальных растворов.
?
Какая из перечисленных технологических операций позволяет разделить жидкие бинарные смеси
– Переэтерификация.
– Темперирование.
– Гидратация.
+ Дистилляция.
?
С какой целью применяется перегонка (дистилляция) с водяным паром
– Для смещения азеотропной точки.
– Для очистки летучих веществ от компонентов с низкой летучестью.
+ Для уменьшения температуры отгонки термически нестойких компонентов.
– Для увеличения выхода летучего компонента.
?
Что представляет собой нода на фазовых диаграммах кипения бинарных смесей (растворов)
– Линия постоянства состава жидкой смеси.
– Линия, связывающая температуры кипения чистых жидкостей.
– Линия или ось состава жидкой смеси.
+ Линия, связывающая равновесные составы жидкости и пара.

