Тесты по химии 11 класс. Тема: “Гибридизация орбиталей”
Правильный вариант ответа отмечен знаком +
1. Сколько σ связей содержит молекула CH₃COOH?
– 4
+ 7
– 5
– 3
2. В молекуле какого вещества орбитали электронов располагаются под углом 109°28’?
+ метана
– ацетилена
– этилена
– аммиака
3. Чем гибридные орбитали отличаются от негибридных?
– электронным облаком и зарядом электронов
– валентным углом и видом гибридизации
– формой и количеством электронов
+ энергией и формой
4. Какую форму имеет молекула вещества при sp2-гибридизации?
+ плоского треугольника
– ромба
– тетраэдра
– трапеции
5. Для какого соединения характерна пространственная конфигурация, представленная на рисунке ниже?
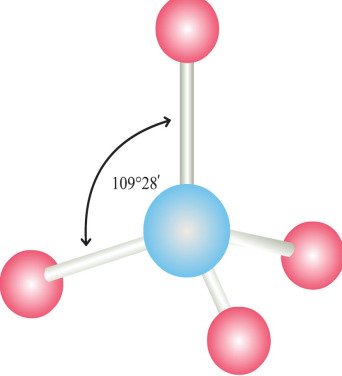
– C2H4
– BF3
+ NCl3
– C2H2
6. Закончите предложение: «Сигма связь – это всегда …».
+ ординарная (простая) связь
– двойная связь
– гибридная связь
– кратная связь
7. Молекула фторида азота (III) имеет … пространственную структуру.
– круговую
– прямоугольную
+ тетраэдрическую
– треугольную
8. Центральному атому свойственна sp3-гибридизация в частице:
– CO2
+ CH4
– NO3
– все ответы верные
9. Какое количество связей в ионе SiF62– сформировано по донорно-акцепторному механизму?
+ 2
– 4
– 1
– 3
тест 10. Какую форму имеет 2s-орбиталь?
– треугольника
+ шара
– квадрата
– пирамиды
11. Укажите, какое строение имеет соединение OF2:
– форму октаэдра
– линейное
– плоское
+ угловое
12. Каким видом гибридизации характеризуется гомологическая цепь CH4, описываемая общей формулой СnН2n+2?
+ sp3
– sp4
– sp2
– sp
13. Какое соединение имеет тип гибридизации sp3d2?
– H2O
– AlCl3
– C2H2
+ SCl6
14. Укажите тип гибридизации орбиталей центрального атома в молекуле CO₂:
+ sp
– d²sp³
– sp3
– sp2
15. В образовании какой связи не принимают участия гибридные орбитали по причине своей симметрии?
+π-связи
– σ-связи
– оба варианта правильные
– нет верного ответа
16. Какую форму имеют гибридные орбитали?
+ неправильной восьмерки
– облака
– перевернутой пирамиды
– изогнутой кривой
17. Чему равно число неподелённых электронных пар n в тригонально-пирамидальной структуре молекул (на примере H2S)?
– 0
– 3
+ 2
– 1
18. Какой тип гибридизации изображен на рисунке ниже?

– sp2
– d²sp³
– sp3
+ sp
19. В молекуле какого вещества содержатся только сигма-связи?
– формальдегида
– бензола
– ацетилена
+ этанола
тест-20. Укажите, строение какого вещества изображено на рисунке:
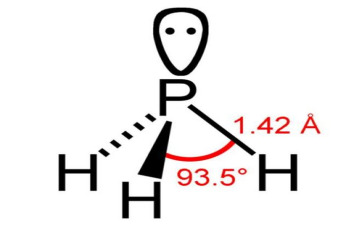
– ортофосфатной кислоты
– металлического фосфора
+ фосфина
– фосфата
21. Укажите соединение, все атомы углерода в молекулах которого пребывают в sp3-гибридном состоянии:
– этилацетат
+ диэтиловый эфир
– уксусная кислота
– все ответы верные
22. Выберите тип гибридизации атомных орбиталей, который характерен для атомов углерода, содержащихся в молекуле 2-метилпентена-2:
– sp2
+ sp3
– sp
– d²sp³
23. Кратная связь имеется в молекуле:
– CH₃NH₂
– CH₃CH(OH)CH₃
– CH2Cl2
+ C₂H₂
24. В молекуле какого вещества электронные орбитали размещаются под углом 180°?
– SiF4
– C6H6
+ ВеF2
– Н2О
25. Треугольная пространственная конфигурация молекулы свойственна:
– CO2
+ BCl3
– CСl4
– NF3
26. Укажите пространственную конфигурацию этина (см. рис.):
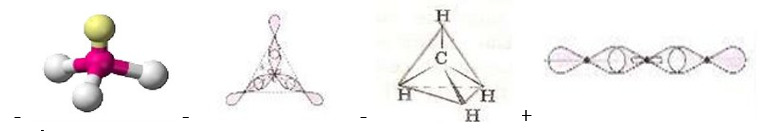
27. sр3-гибридные орбитали имеет частица:
+ BH4
– ClF3
– HClO4
– PCl5
28. Укажите вещество с максимальным количеством σ связей в молекуле:
– CH2=CH−CH=CH2
– н-бутан
– C4H6
+ C4H8
29. Какой постулат используется для определения максимального количества электронов на орбитали?
– правило Клечковского
+ принцип Паули
– правило Гунда
– принцип Гейзенберга
тест_30. Молекулы какого соединения имеют пирамидальное строение?
– GaF3
+ NH3
– BF3
– всех вышеуказанных

