Тесты по химии 10 класс. Тема: “Скорость химических реакций. Химическое равновесие”
Правильный вариант ответа отмечен знаком +
1. Что способствует получению пропана в процессе химического взаимодействия С3Н6(г) + Н2(г) ↔ С3Н8(г) + Q?
– введение катализатора
+ повышение давления
– увеличение температуры
– уменьшение концентрации Н2
2. Во сколько раз целесообразно повысить давление системы, в которой происходит превращение NO в NO2, с целью повышения скорости реакции в 729 раз?
– 6
+ 9
– 8
– 12
3. Установите последовательность направленности смещения химического процесса, который описывается уравнением СО ↔ СО2 + С + Q вследствие: а) применения катализатора; б) понижения давления; в) увеличения концентрации карбона; г) возрастания температуры
– влево; влево; вправо; вправо
– влево; влево; не влияет; влево
+ не влияет; влево; не влияет; влево
– не влияет; влево; влево; вправо
4. При обычных условиях с максимальной скоростью осуществляется взаимодействие между:
– N2, О2
– Fe, S
– C2H5OH, О2
+ Na2CO3, HCl
5. Что за формула представлена на рисунке ниже?
![]()
– разности концентраций химических соединений, вступающих в химическую реакцию
+ скорости химического взаимодействия
– соотношения концентрации насыщенных и ненасыщенных растворов
– теплосодержания системы (энтальпии)
6. За счёт введения катализатора течение химического процесса ускоряется, поскольку…:
– снижается теплота реакции
– увеличивается частота соударений молекул
– повышается теплота реакции
+ снижается энергия активации
7. Как называется вещество, замедляющее процесс химической реакции?
– индикатор
– катализатор
+ ингибитор
– фермент
8. Две ёмкости заполнили равным объёмом HCl одной концентрации. В первую ёмкость добавили цинковые таблетки, во вторую – равную им по массе цинковую пыль. В какой из ёмкостей раньше завершится реакция?
– в первой
+ во второй
– в обеих одновременно
– и в том, и в другом случаях реакция протекать не будет
9. На динамическом равновесии какой из реакций не сказывается давление?
– 3Н2 + N2 ↔ 2NH3
– 2SO2 + O2 ↔ 2SO3
– CO + Cl2 ↔ COCl2
+ Н2 + Cl2 ↔ 2HCl
тест 10. Показателем необратимого химического процесса является:
– изменение цвета раствора
+ выпадение осадка
– поглощение большого количества теплоты
– все ответы верные
11. Обратимая реакция представлена уравнением:
– Na2О + 2HCl ↔ 2NaCl H2О
– FeCl3 + 3NaOH ↔ Fe(OH)3 + 3NaCl
+ N2 + 3Н2 ↔ 2NH3
– КОН + НСl ↔ KCl + Н2О
12. Химический процесс описывается уравнением А + В ↔ С + Д. Смешали по 3 моля веществ А, В, С. После установления равновесия в смеси будет находиться 4 моль вещества С. Чему будет равна константа равновесия?
– четырём
+ единице
– трём
– двум
13. С максимальной скоростью протекает:
– процесс самопроизвольного разъедания металлов на воздухе
– брожение глюкозы
+ реакция нейтрализации
– взаимодействия водорода с бромом
14. Примером обратимой химической реакции является процесс:
– растворения сахара в чае
– расширения газа в пустоту
+ гидролиза сложного эфира
– старения организма
15. Как изменяется быстрота прямой реакции С3Н8 (г) + О2 (г) = СО2(г) + Н2О(г), если в 2 раза повышается давление?
– возрастает в 128 раз
+ возрастает в 64 раза
– возрастает в 26 раз
– возрастает в 10 раз
16. Что обозначает константа скорости реакции?
– усреднённую быстроту химического процесса
+ скорость процесса при концентрации реагентов 1 моль/л
– быстроту в начальный период времени
– быстроту химического взаимодействия в определённый момент
17. Что необходимо сделать, чтобы сместить равновесие системы СО2(г) + С(тв) =2СО(г) в направлении прямой реакции?
+ понизить концентрацию СО
– увеличить давление системы
– повысить концентрацию СО
– снизить концентрацию углекислого газа
18. Между какими контактирующими веществами площадь поверхности не сказывается на скорости химического взаимодействия?
– Zn, HCl
– FeS2, O2
+ N2, H2
– CuO, Al
19. Температурный показатель реакции 2А (г) + 3В (г) = 4С (г) равен трём. Как изменится быстрота протекания реакции, если температуру снизить на 50 0С, а концентрацию реагирующих веществ повысить в три раза?
+ не изменится
– уменьшится в 243 раза
– увеличится в 243 раза
– уменьшится в 81 раз
тест-20. С понижением давления динамическому равновесию свойственно смещаться в направлении …:
– процесса, протекающего с уменьшением числа молекул продуктов реакции
– концентрации реагирующих веществ
– уменьшения количества газообразных веществ
+ увеличения объёма реакционной смеси
21. В каком направлении и как изменится равновесие системы СО ↔ СО2 + С + Q с увеличением давления и снижением температуры соответственно?
– не изменится; вправо
+ вправо; вправо
– влево; влево
– вправо, влево
22. Катализатор AlCl3 увеличивает быстроту:
– любого химического взаимодействия между органическими соединениями
+ некоторых химических процессов между органическими веществами
– любого взаимодействия между неорганическими соединениями
– некоторых реакций между неорганическими веществами
23. Выберите верное значение: «Длительность химической реакции с температурным коэффициентом 2 (значение коэффициента равно для 30 0С) заканчивается через 5 мин. Чтобы ускорить протекание данной реакции до 30 с, следует повысить температуру на … градусов Цельсия».
+ 130
– 100
– 50
– 300
24. От какого показателя не зависит скорость химического взаимодействия в растворах?
– объёма реакционной посуды
– катализатора
– концентрации веществ
+ индикатора
25. В какой из систем произойдёт одностороннее изменение химического равновесия, если в ней повысить давление и снизить температуру?
– С2H2(г)↔ 2С + Н2 – Q
+ N2 + 3Н2 ↔2NH3 + Q
– N2 + О2↔ 2NO – Q
– Н2 + Cl2↔ 2HC1 + Q
26. Как отражается на поведении реакции повышение температуры?
– никак не сказывается на её скорости
+ возрастает быстрота реакции
– снижается скорость реакции
– нет верного ответа
27. Для изменения равновесия химического взаимодействия согласно уравнению CaCO3(т) = CaO(т) + CO2(т) – Q в направлении продуктов реакции следует:
+ увеличить Т
– снизить Т
– увеличить р
– ввести в систему катализатор
28. Какие факторы (а) увеличение концентрации азота, б) температура, в) давление, г) уменьшение концентрации кислорода, д) катализатор) не влияют на равновесие химического процесса N2 (г) + O2 (г) ↔ NO (г) – 180, 7 кДж/моль?
– 1, 2, 4
– 2, 3
+ 3, 5
– 1, 2
29. Укажите, что за формула представлена на рисунке ниже:
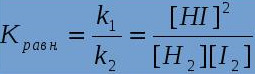
– расчёта концентрации веществ химического взаимодействия
– определения константы растворимости
+ вычисления константы химического равновесия
– определения константы диссоциации слабых электролитов
тест_30. Насколько справедливы представленные ниже утверждения относительно смещения химического равновесия системы 2CO(г) + O2(г) = 2CO2(г) + Q?
1. Со снижением давления произойдёт смещение химического равновесия системы в направлении продукта реакции.
2. С увеличением концентрации СО2 наблюдается смещение химического равновесия системы в сторону продукта реакции.
– справедливо лишь утверждение 1
– справедливо лишь утверждение 2
– справедливы оба утверждения
+ оба утверждения неверны

