Тесты по химии 11 класс. Тема: “Гидролиз”
Правильный вариант ответа отмечен знаком +
1. Какое из приведённых ниже кратких определений принадлежит понятию «гидролиз»?
– замещение аминогруппы
– выделение веществ на электродах
– разложение воды фотонами
+ разложение соединений с участием воды
2. Гидролизу подвергаются:
– только неорганические соединения
+ органические и неорганические соединения
– только органические соединения
– исключительно соли
3. Какие вещества образуются в результате гидролиза высокомолекулярных соединений – галогеналканов?
– щёлочь
– моносахариды
– аминокислоты
+ спирты
4. Примером диссоциации кислоты, являющейся слабым электролитом, будет:
– H2SO4 ↔ 2H+ + HSO42-
– HNO3 ↔ H+ + NO3–
+ H2CO3 ↔ H+ + HCO3–
– HCl ↔ H+ + Cl–
5. Количество гидроксид-ионов определяет кислотность основания. Двухкислотным основанием является:
+ Ca(OH)2
– KOH
– NaOH
– Al(OH)3
6. Если гидролиз идёт по катиону и разрушается остаток основания, то среда будет:
– щелочной
+ кислой
– нейтральной
– слабощелочной
7. Обычно, гидролиз – обратимый процесс, но существуют два исключения, когда соли образованы:
– сильной кислотой и слабым основанием, слабой кислотой и сильным основанием
– слабой кислотой и слабым основанием, сильной кислотой и слабым основанием
– слабой кислотой и сильным основанием, сильной кислотой и сильным основанием
+ сильной кислотой и сильным основанием, слабой кислотой и слабым основанием
8. При разбавлении раствора равновесие смещается вправо, и гидролиз усиливается, а при увеличении ионов водорода равновесие смещается влево, и гидролиз ослабевает. Это соответствует:
– закону кратных отношений
– закону Гей-Люссака
– правилу постоянства химического состава
+ принципу Ле Шателье
9. Гидролиз является разновидностью:
– аммонолиза
– алькоголиза
– гидратации
+ сольволиза
тест 10. На иллюстрации изображён продукт, который получают с помощью гидролиза. Гидролиза каких веществ?

– галогеналканов
– углеводов
– белков
+ жиров
11. Что образуется в результате обменных реакций ионов соли и воды?
– сильный электролит
+ слабый электролит
– сильный или слабый электролит (зависит от типа соли)
– сильный или слабый электролит (зависит от характера среды)
12. Какие соли не подвергаются гидролизу из-за наличия гидратных оболочек?
– образованные слабой кислотой и сильным основанием
– образованные сильной кислотой и слабым основанием
– образованные слабой кислотой и слабым основанием
+ образованные сильной кислотой и сильным основанием
13. Если гидролиз идёт по аниону, то для него характерны:
– ступенчатость, слабокислая среда, обратимость
+ ступенчатость, слабощелочная среда, обратимость
– нейтральная среда, необратимость
– необратимость
14. Если гидролиз идёт по катиону, то для него характерны:
– ступенчатость, слабощелочная среда, обратимость
+ ступенчатость, слабокислая среда, обратимость
– необратимость
– нейтральная среда, необратимость
15. Гидролиз соли, которая образована слабым основанием и слабой кислотой идёт по:
– катиону
– аниону
+ катиону и аниону
– такая соль не гидрализируется
16. На иллюстрации изображён гидролиз, конечными продуктами которого являются моносахариды и ортофосфорная кислота. Какие вещества в данном случае подвергаются гидролизу?
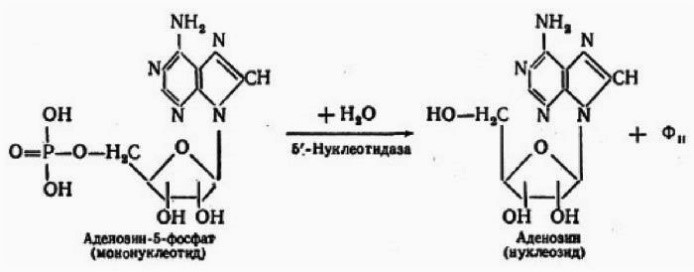
– белки
– углеводы
– жиры
+ нуклеиновые кислоты
17. Гидролиз белков – это:
+ разрушение первичной структуры в водном или щелочном растворе с образованием свободных аминокислот
– разрушение первичной и вторичной структуры щелочном растворе с образованием аминокислот
– разрушение первичной структуры в водном растворе
– разрушение первичной структуры в водном растворе с образованием свободных аминокислот
18. Гидролиз соли NaCl (хлорид натрия) не происходит, потому что:
– она образована нерастворимым основанием
– она является нерастворимой
– она образована слабой кислотой и слабым основанием
+ она образована сильной кислотой и сильным основанием
19. Что из приведённого ниже не усиливает гидролиз?
+ увеличение концентрации растворённого вещества
– увеличения концентрации растворителя
– нагревание
– связывание продукта в труднорастворимое соединение
тест-20. Что из приведённого ниже не подавляет гидролиз?
– подщелачивание
– охлаждение
+ удаление продукта в газовую фазу
– увеличение концентрации растворителя
21. Алкоголята являются производными спиртов, при гидролизе они распадаются на:
– спирты и карбоновые кислоты
– спирты
– глицерин и соли карбоновых кислот
+ спирты и щёлочь
22. Константа гидролиза показывает способность вещества подвергаться электролитической диссоциации. Для каких гидролитических процессов она характерна?
– обратимых (по катиону и аниону)
– необратимых (по катиону и аниону)
+ обратимых (по аниону, по катиону)
– необратимых (только по катиону)
23. Продолжите фразу: образованные при гидролизе солей слабые электролиты…
– практически мгновенно распадаются ионы
+ практически не распадаются на ионы
– не способны распадаться на ионы
– выпадают в осадок и не распадаются на ионы
24. К специальным случаям гидролиза относиться соль:
+ NH4NO3
– AlCl3
– CH3COONa
– (NH4)2S
25. Степень гидролиза – это:
– отражение равновесия реакции
– совокупность концентрации анионов и катионов
– процентное соотношение катионов и анионов
+ отношение количества подвергшихся гидролизу молекул электролита к общему числу молекул электролита
26. В 1888 году Вильгельм Оствальд установил закон разбавления веществ, позволявший определять константы диссоциации. Какие количественные показатели гидролиза взаимосвязаны через уравнение Оствальда?
– концентрация и растворимость
– концентрации анионов и катионов
+ константа и степень
– количество начальных и конечных продуктов
27. Чтобы избежать хлороза у растений, в почву с пониженной кислотностью вносят (NH4)2SO4. pH почвы снижается благодаря гидролизу:
– по аниону
+ по катиону
– по катиону и аниону
– зависит от конкретной pH
28. Ступенчатый гидролиз наблюдается в случае, когда соль образована:
– однокислотным основанием или одноосновной кислотой
– двухкислотным основанием и двухосновной кислотой
+ многокислотным основанием или многоосновной кислотой
– в любом случае

