Тесты по химии 11 класс. Тема: “Химические реакции”
Правильный вариант ответа отмечен знаком +
Вариант 1
1. К химическим реакциям по изменению степени окисления не относятся химические реакции:
+ обмена
– соединения
– разложения
2. К реакциям разложения относятся:
– взаимодействие лития с кислородом
+ распад оксида ртути на ртуть и кислород
– взаимодействие цинка с соляной кислотой
3. К реакциям соединения относятся:
+ взаимодействие алюминия с серой
– взаимодействие уксусной кислоты с магнием
– взаимодействие магния с водородом
4. К реакциям замещения относятся:
+ взаимодействие цинка с соляной кислотой
– взаимодействие углерода с водородом
– взаимодействие лития с кислородом
5. Процессы, в результате которых происходит изменение степеней окисления, называются:
– горением
– тепловым эффектом
+ окислительно – восстановительными реакциями
6. Какой метод используется при расстановке коэффициентов в уравнении?
+ электронного баланса
– перестановки
– распределения
7. По числу и составу исходных и образующихся веществ не относится реакция:
+ по радикальному механизму
– соединения
– замещения
8. К реакциям разложения относится:
+ 2 KClO3= 2 KCl + 3O2 (газ)
– 2 Fe + 3 Cl2 = 2 FeCl3
– HCOOH + NaOH — ≥ HCOONa + H2O
9. К реакциям соединения относится:
+ 2 Fe + 3 Cl2 = 2 FeCl3
– CH4 + Cl2 — ≥(свет) CH3Cl + HCl
– 2 СH4 =(t) C2H2 (газ) + 3H2 (газ)
тест 10. К реакциям характерным для органических веществ относится:
+ идущие по ионному механизму
– замещения
– соединения
11. По тепловому эффекту реакции подразделяются на:
+ экзотермические и эндотермические
– обратимые и необратимые
– идущие по радикальному механизму и ионному механизму
12. Экзотермическими называют реакции, которые:
+ идут с выделением теплоты
– идут с поглощением теплоты
– идут до полного израсходования одного из реагирующих веществ
13. Эндотермическими называют реакции, которые:
– идут с выделением тепла
+ идут с поглощением тепла
– идущие при данных условиях во взаимно противоположных направлениях
14. Примером эндотермической реакции является:
– H2(г) + Сl2 (г) = 2 HCl ( г) + 184.6 кДж
+ ½ N2(г) + 1/2O2 (г) = NO( г) – 90.4 кДж
– H2(г) + 1/2O2 (г) = H2O( жидк.) + 285.8 кДж
15. Теплотой образования называют:
+ уровень теплоты, который выходит или используется при выделении одного моля соединения из простых веществ
– уровень теплоты, который выходит при сгорании одного моля вещества
– уровень теплоты, выходящий или используемый при реакции
16. Теплотой сгорания называют:
– уровень теплоты, выходящий или используемый при выделении одного моля соединения из простых веществ
+ уровень теплоты, выходящий при сгорании одного моля вещества
– уровень теплоты, выходящий или используемый при реакции
17. Термохимическими называют реакции, в которых указано:
– уровень теплоты, выходящий или используемый при образовании одного моля соединения из простых веществ
– уровень теплоты, выходящий при сгорании одного моля вещества
+ уровень теплоты, выходящий или поглощаемый при реакции
18. По признаку обратимости реакции подразделяются на:
+ обратимые и необратимые
– экзотермические и эндотермические
– замещения, обмена, разложения, соединения
19. Необратимой называется реакция:
+ идущая до конца, то есть до полного израсходования одного из реагирующих веществ
– которая идет во взаимно противоположных плоскостях
– идущая с выделением теплоты
тест-20. Обратимой называется реакция:
– идущая до конца, то есть до полного израсходования одного из реагирующих веществ
+ которая идет во взаимно противоположных плоскостях
– идущая с выделением теплоты
Вариант 2
1. Чему равен коэффициент окислителя в реакции, протекающей согласно схеме Al + H2SO4 = Al2(SO4)3 + H2?
+ трём
– единице
– четырём
– двум
2. Выберите вещества, после вступления в реакцию которых образуется химический процесс, который можно описать сокращенным ионным уравнением 2H+ + CO32- = H2O + CO2:
– NaHCO3 + HCl
+ Na2CO3 + HCl
– CaCO3 + HCl
– Na2CO3 + CH3COOH
3. К соединительным реакциям относится:
+ взаимодействие Al с S
– взаимодействие CH3COOH с Mg
– взаимодействие Mg с H2
– все ответы верные
4. Какая реакция не является окислительно-восстановительной?
– ароматизации циклоалканов
– гидрирования жиров
– гидратации алкенов
+ гидролиза жиров
5. Из представленных ниже вариантов выберите необратимую реакцию:
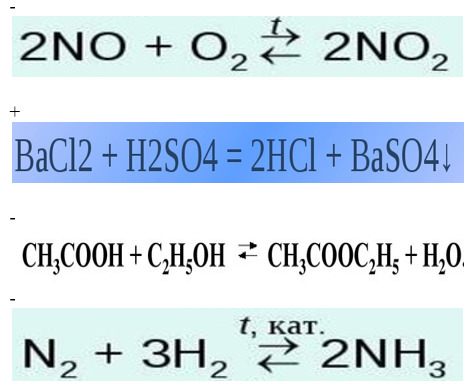
6. Как называется раствор, вещество в котором при определённой температуре не подлежит растворению?
– перенасыщенный
– разбавленный
+ насыщенный
– концентрированный
7. К обратимой относятся реакции, которые:
– протекают до конца
+ идут во взаимно противоположных плоскостях
– заканчиваются выделением тепла
– происходят лишь с применением катализатора
8. Повысить скорость химического взаимодействия, описываемого уравнением 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q, возможно, если:
+ мелко подробить железный колчедан
– применять воздух, насыщенный азотом
– абсорбировать SO2 водой
– уменьшить температуру
9. Как называется метод, предназначенный для уравнения химических реакций?
+ электронного баланса
– электролитической диссоциации
– распределения
– электроотрицательности
тест 10. Гидролизу не подвергается соль:
+ КCl
– K2CO3
– FeCl2
– ZnSO4
11. Окислительно-восстановительная реакция – это:
– гидролиз (C₆H₁₀O₅)n
+ гидрирование C2H2
– полимеризация C₅H₈O₂
– нейтрализация CH₃COOH гидроксидом кальция
12. Газ, выделяющийся вследствие реакции между СaC2 и Н2О:
– CH4
+ C2H2
– C2H4
– C3H8
13. Что подразумевается под «теплотой сгорания»?
– степень тепла, вышедшая либо израсходованная в процессе выделения 1 моль вещества из простого соединения
– изменение энтальпии химической системы за счёт протекания взаимодействующей реакции
+ количество тепла, получаемое при сгорании 1 моль вещества
– нет правильного ответа
14. Щелочной показатель рН характерен для раствора:
+ CH₃COONa
– Ba(NO₃)₂
– Fe₂(SO₄)₃
– Al(NO3)3
15. Какой тип химических реакций не классифицируется по количеству и составу исходных и конечных веществ?
+ по радикальному механизму
– обмена
– соединения
– замещения
16. Кислотный рН характерен для водного раствора:
– AgCl
– Na2SO4
– CH3COONH4
+ FeCl3
17. Реакцией разложения является:
– взаимодействие Li с O2
+ распад HgO на Hg и O2
– взаимодействие Fe с CuSO4
– взаимодействие Zn с HCl
18. В результате какой реакции состав вещества остаётся прежним?
– C(графит) + O2 = CO2
– 2SO2 + O2 = 2SO3
+ 3O2 = 2O3
– 3H2 + N2 = 2NH3
19. На смещение равновесия системы N2(г) + О2(г) = 2NO(г) – Q не влияет:
– повышение температуры
– повышение концентрации NO
+ повышение давления
– уменьшение концентрации N2
тест-20. Скорость прямого взаимодействия в системе N2 + 3H2 = 2NH3 + Q возрастает при:
+ увеличении концентрации азота
– уменьшении концентрации аммиака
– уменьшении концентрации азота
– увеличении концентрации аммиака
21. По характеру обратимости реакции классифицируются на:
– идущие с изменением и без изменения степени окисления атомов
– экзотермические, эндотермические
– соединения, разложения, обмена, замещения
+ обратимые, необратимые
22. Взаимодействие NaOH с H₃PO₄ относится к реакциям:
– разложения
– замещения
– присоединения
+ обмена
23. Какая соль в водном растворе изменяет цвет фенолфталеин на малиновый?
+ K2S
– Na2SO4
– Al₂(SO₄)₃
– Al₂S₃
24. К реакциям замещения относится:
+ взаимодействие Zn с HCl
– взаимодействие NaOH с HCl
– взаимодействие C с H2
– взаимодействие Li с O2
25. Кислый рН характерен для водного раствора:
– Na3PO4
– KCl
– Na2CO3
+ ZnSO4
26. Уравнение 2Na + 2H2O = 2NaOH + H2 + Q описывает реакцию:
– обменную, эндотермическую
+ замещения, экзотермическую
– распада, экзотермическую
– присоединения, эндотермическую
27. Какое вещество образуется путём соединения водных растворов Na2CO3 и Al₂(SO₄)₃:
– карбонат алюминия
– карбид алюминия
+ гидроксид алюминия
– оксид алюминия
28. Эндотермические реакции – это те, которые:
+ идут с поглощением теплоты
– протекают в обычных условиях, но в противоположных направлениях
– невозможны без участия катализатора
– протекают с выделением теплоты
29. Укажите, чему равно значение коэффициентов химической реакции Mg + HNO3 = Mg(NO3)2 + N2 + H2O:
– 5
– 12
+ 29
– 32
тест_30. К какому типу относится реакция, отображенная на рисунке ниже?
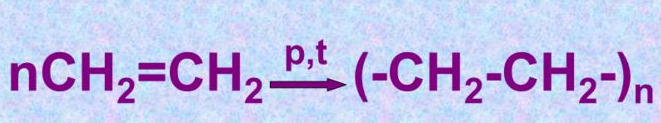
+ присоединения
– обмена
– замещения
– разложения

