Тесты по химии 8 класс. Тема: “Окислительно-восстановительные реакции”
Правильный вариант ответа отмечен знаком +
1. Чему равна степень окисления P в оксиде P2O5?
– плюс 2
+ плюс 5
– плюс 1
– плюс 4
2. Укажите вариант, в котором формула вещества не является окислителем:
– CuO
– H2SO4(конц.)
+ HNO3
– Br2
3. Как изменяется степень окисления веществ при отдаче электронов?
– никак не изменяется
+ снижается
– повышается
– нет такого понятия как степень окисления
4. В окислительно-восстановительной реакции, которая протекает согласно уравнению Si H4 + O2 = SiO2 + H2O, суммарный показатель коэффициентов равен:
– 2
– 3
– 5
+ 6
5. Окислительное число +2 в соединениях присуще:
– Fe, Ca, Al
– галогенам
+ металлам главной подгруппы второй группы периодической системы Д.И. Менделеева
– щелочным металлам
6. Атомы элементов-металлов являются восстановителями по той причине, что …
+ способны отдавать электроны
– способны как отдавать, так и присоединять электроны
– способны присоединять электроны
– не способны изменять степень окисления
7. Степень окисления атомов простых соединений, а также атомов, находящихся в свободном состоянии, равна:
– плюс 4
+ 0
– плюс 2
– плюс 1
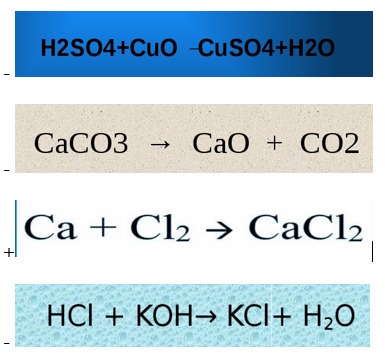
8. Выберите вариант, в котором указана окислительно-восстановительная реакция:
9. Типичным восстановителем является ион …
– Cr3+
+ CI-
– H+
– Fe3+
тест 10. Укажите вещество, в котором элементы имеют окислительное число +3 и -1:
– N2O5
– CO2
+ PF3
– MgCl2
11. Выберите ряд, где степень окисления кислорода у всех соединений равна О-2:
– CO2, OF2, O2
– H2O, CuO, AI2O3
– O2, H2O2, CO
+ WO3, H2CO3, CO
12. Чему равна сумма коэффициентов уравнения реакции Cu + 4HNO3 = Cu (NO3)2 + 2NO2 + 2H2O?
+ 10
– 7
– 5
– 3
13. Какие химические реакции называются окислительно-восстановительными?
– те, в результате которых наблюдается отдача электронов
– те, при которых происходит отдача протонов и нейтронов
+ те, в ходе которых происходит изменение степеней окисления веществ
– те, в результате которых наблюдается приём электронов
14. Какого типа ОВР не существует?
– дисмутации
– внутримолекулярного
+ разложения
– межмолекулярного
15. В преобразовании N+5 –> N-3 значение принятых электронов составляет:
– пять
+ восемь
– два
– три
16. Окислительное число N в указанных соединениях (N2O5, HNO3, NaNO3, Fe(NO3)3) равно:
– 0
– плюс 2
– плюс 3
+ плюс 5
17. Нулевую степень окисления Cl как химический элемент имеет в соединении:
+ Cl2
– MgCl2
– CaCl2
– KCl
18. Какое из веществ выступает наиболее сильным окислителем?
– F
+ электроток на аноде при электролизе
– O2
– H2SO4(конц.)
19. Ион, окислительное число которого повышается, называется …:
– нейтральным ионом
– окислителем
– степенью окисления
+ восстановителем
тест-20. Установите, чему равна степень окисления P в соединении K4P2O7:
– плюс 4
– минус 3
+ плюс 5
– минус 5
21. В гидридах металлов (см. рис.) окислительное число H всегда равно:
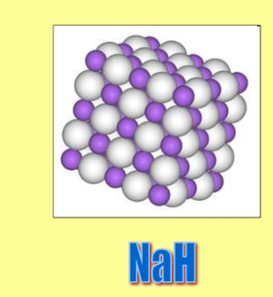
– +2
– 0
+ -1
– +1
22. Учитывая электронную атомарную структуру, выберите ту частицу, которая может быть окислителем:
– Cl-
+ К+
– атом Na
– F-
23. Суть электронного баланса заключается в:
– определении и сравнении молекулярной массы веществ
+ сопоставлении окислительного числа химических элементов
– установлении валентности веществ в соединении
– составлении и написании полуреакций
24. В нитрате железа (II) (Fe(NO3)2) показатель степени окисления Fe равен:
– плюс 5
– плюс 3
+ плюс 2
– плюс 4
25. Значение степени окисления серы (S) в сульфиде калия (K₂S) составляет:
+ минус 2
– 0
– плюс 2
– минус 1
26. Из предложенных вариантов выберите схему ОВР, где H2O выступает окислителем:
– F2 + Н2O →
– Cl2 + Н2O →
+ Na + H2O→
– Н2O → H2↑ + O2
27. ОВР невозможна между:
– SO₂ и H₂S
– NH3 и KMnO4
+ HCl и H2Se
– S и HNO₃
28. Наименьший показатель степени окисления N имеет в веществе:
– KNO3
– N2О
+ NH3
– HNO2
29. В момент, когда атом вещества принимает электроны, степень его окисления:
+ снижается
– остаётся без изменений
– повышается
– становится равной нулю
тест_30. В сульфате железа (II) (FeSO4) окислительное число серы (S) составляет:
– +2
– -1
+ +6
– +4

