Тесты по химии 8 класс. Тема: “Строение электронных оболочек атомов”
Правильный вариант ответа отмечен знаком +
1. Что образуют электроны, постоянно двигаясь вокруг ядра?
– нейтроны
+ электронное облако
– атомы
– внешнюю оболочку
2. Для какого химического элемента характерна завершенность на внешнем энергетическом уровне?
– K
– Zn
+ Rn
– P
3. Внешний энергетический уровень атома As является … по счёту.
– первым
– вторым
– третьим
+ четвёртым
4. Какая конструктивная модель атома была установлена в ХХ веке?
– кругосветная
+ планетарная
– радиусная
– радиальная
5. Какая энергия у электронов, находящихся на ближайшей к ядру орбите?
+ минимальная
– максимальная
– одинаковая
– кинетическая
6. В какой последовательности размещаются электроны в атоме Ar?
– 2, 8, 1
– 2, 4
– 2, 6, 10
+ 2, 8, 8
7. Количество электронов на внешнем энергетическом уровне химических элементов А подгрупп соответствует номеру …
– периода
– электронной орбитали
+ группы
– подгруппы
8. Вокруг чего движутся электроны?
– атомов
– ионов
+ ядра
– молекул
9. У атома Na на внешнем уровне содержится:
– пять электронов
+ один электрон
– восемь электронов
– шесть электронов
тест 10. Составляющими атома являются:
– протоны и нейтроны
– нуклоны
– молекулы
+ ядро и электроны
11. Количество электронов в оболочке атома соответствует числу:
– нуклонов
+ протонов
– календаря
– нейтронов
12. Распределение электронов по энергетическим уровням в последовательности 2ē, 8ē, 2ē характерно для атома:
+ Mg
– S
– N
– Be
13. Какое максимальное число электронов содержится на 4 уровне?
– 48
– 18
+ 32
– 24
14. Какой заряд имеет атом?
+ атом электронейтрален
– атом не имеет заряда
– отрицательный
– положительный
15. Каким свойством обладает электрон?
– молекул
+ волн
– гранул
– импульса
16. Какая формула используется для расчёта максимального количества электронов на внешнем энергетическом слое?
– 2n
– (2n)2
– n2
+ 2n2
17. Какое максимальное количество электронов может содержаться на первом энергетическом уровне?
– шесть
– один
– четыре
+ два
18. Количество электронов на внешнем слое соответствует:
– атомной молекулярной массе химического элемента
+ номеру группы
– порядковому числу
– номеру периода
19. Какое количество электронных уровней имеет атом Cl?
+ три
– один
– два
– четыре
тест-20. S-орбиталь содержит максимально … электрона.
– четыре
+ два
– двадцать четыре
– тридцать два
21. Укажите верное утверждение:
+ р-орбиталь максимально содержит 6 электронов
– на каждом энергетическом слое может располагаться по 8 электронов
– р-орбиталь максимально содержит 3 электрона
– на s-орбитале минимально может располагаться 2 электрона
22. Ядро атома С имеет … энергетических уровня.
+ 2
– 3
– 4
– не имеет энергетических уровней
23. Какому химическому элементу соответствует электронная схема, изображённая на рисунке?
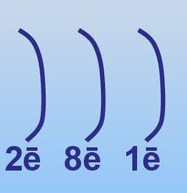
+ Na
– F
– Cu
– Ag
24.Как называется химический элемент, атом которого содержит 12 нейтронов, 12 протонов и 12 электронов?
– N
– C
– S
+ Mg
25. Атомы каких элементов имеют разное число электронных слоёв?
– серы, фосфора
+ фтора, брома
– серы, хлора
– кальция, калия
26. Укажите формулу, которая используется для расчёта массового числа атомов:
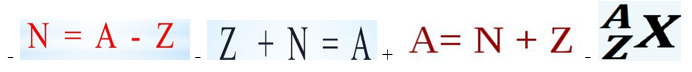
27. Где в таблице Д.И. Менделеева расположены изотопы?
– в одном периоде
– в одной группе
+ в месте пересечения изобарной, изотопной, изонейтронной и изодифферентной линий
– в правом верхнем углу
28. Числом каких частиц отличаются изотопы?
– протонов
+ нейтронов
– электронов
– все ответы верные
29. Атом Si содержит на внешнем слое … электронов.
+ 14
– 6
– 12
– 8
тест_30. Какое количество электронов находится на внешнем уровне атома S?
– два
– три
+ шесть
– десять

