Тесты по химии 9 класс. Тема: “Классификация неорганических веществ”
Правильный вариант ответа отмечен знаком +
Вариант 1
1. Какая из формул соответствует амфотерному гидроксиду?
+ Al(OH)3
– Ca(OH)2
– Cu(OH)2
– NaOH
2. Высший оксид элемента с порядковым номером 16 относится к оксидам:
– основным
+ кислотным
– амфотерным
– несолеобразующим
3. Веществами Х1, Х2 в цепочке химических превращений ZnO – X1 – X2 – Zn(OH)2 являются:
– ZnCl2, ZnO
– Zn(OH)2, ZnCl2
– Zn(OH)2, ZnSO4
+ ZnCl2, ZnSO4
4. Как называется соединение, состоящее из металла и кислотного остатка?
– оксид
+ соль
– кислота
– основание
5. Выберите формулу основной соли:
– Cu(OH)2
+ (CuOH)Cl
– SO2(OH)2
– CuCl2 ∙ 5H2O
6. Укажите ряд, в котором приведены формулы соответственно основного, кислотного и несолеобразующего оксидов:
– Na2O, ZnO, P2O5
+ K2O, SO3, NO
– BaO, Al2O3, CO
– MgO, SO2, Mn2O7
7. Гидроксид железа (III) образуется при действии растворов щелочей на:
– оксид железа (II)
– оксид железа (III)
– растворы солей железа (II)
+ растворы солей железа (III)
8. Какое вещество относится к классу солей?
– H2SO4
+ Na2SO4
– NaOH
– HNO3
9. Укажите формулу кислой соли:
– MgH2
+ NaHCO₃
– Ca(OH)₂
– (CuOH)2CO3
тест 10. Где в периодической таблице расположены неметаллы?
+ в верхнем правом углу
– в нижнем правом углу
– в верхнем левом углу
– в нижнем левом углу
11. Оксид углерода (IV) реагирует с каждым из двух веществ:
+ водой и оксидом кальция
– кислородом и оксидом серы (IV)
– сульфатом калия и гидроксидом натрия
– фосфорной кислотой и водородом
12. Какой из элементов может образовать кислотный оксид?
– стронций
– марганец
+ кальций
– магний
13. Формулы кислот в порядке последовательного увеличения их силы слева направо записаны в рядах:
– H3AsO4, H3PO4, HNO3
+ H2SiO3, H2CO3, HNO3
– HClO4, HClO, H2SO3
– HF, HCl, HI
14. При прокаливании Cr(OH)3 образуется:
– вода, оксид хрома (II)
+ вода, оксид хрома (III)
– вода, оксид хрома (VI)
– вода, хром
15. Двухосновной является кислота:
+ сероводородная
– азотная
– соляная
– фосфорная
16. Укажите амфотерный гидроксид:
+ Pb(OH)2
– N2O5
– Cu(OH)2
– Fe(OH)2
17. Вещество, которое является продуктом замещения атомов водорода в кислоте на атомы металла, называется:
– кислотой
+ солью
– оксидом
– основанием
18. Ca(HCO3)2 – это:
+ кислая соль
– комплексная соль
– основная соль
– двойная соль
19. Растворимые в воде основания называют:
– солями
– кислотами
+ щёлочами
– оксидами
тест-20. Какие соли называются гидратными?
– в состав которых входит гидроксильная группа
– которые содержат кислотный остаток
+в состав которых входят молекулы кристаллизационной воды
– которые содержат анионы кислотных остатков и катионы металлов
21. Реакцией нейтрализации называют взаимодействие:
– кислоты и соли
+ кислоты и основания
– основания и соли
– металла и кислоты
22. Укажите формулу двухкислотного основания:
– KOH
– Mn(OH)4
+ Ca(OH)2
– Al(OH)3
23. Формула щёлочи:
– HBr
+ KOH
– HNO3
– Mg(OH)2
24. К сложным веществам относится:
+ сода
– йод
– графит
– воздух
25. Данный оксид N2O относится по химическим свойствам к:
– амфотерным
– кислотным
– основным
+ несолеобразующим
26. В схеме превращений CaCO3 – X1 – X2 + NaCl веществом Х2 является:
+ CaCO3
– CaCl2
– CaO
– Ca(OH)2
27. Какая из перечисленных солей относится к фосфатам?
+ Ca3(PO4)2
– MgCl2
– H3PO4
– NH4NO3
28. Формулы только сильных кислот приведены в рядах:
+ HCl, HBr, HI
– CH3COOH, HBr, H2SO4
– H2SO4 (разб.), HNO3, HCl
– HBr, HI, HF
29. К амфотерным оксидам относится:
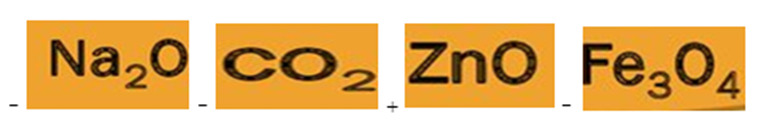
тест_30. Структурная формула какого соединения представлена на рисунке?
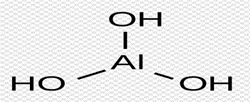
– оксида алюминия
– гидроксид аммония
+ гидроксида алюминия
– нет верного ответа
Вариант 2
1. По составу неорганические вещества можно разделить на две большие группы:
– соли и металлы
– оксиды и гидроксилы
– металлы и неметаллы
+ простые и сложные
2. Для сложных веществ характерной чертой является:
– немногочисленность (всего около 400 веществ)
– разделение по типу химической связи на металлы и неметаллы
– они представляют собой форму существования элементов в свободном виде
+ они состоят из нескольких элементов
3. Какое из перечисленных свойств не относится к металлам?
+ высокая окислительная активность
– высокая пластичность
– высокая теплопроводность
– высокая электропроводность
4. Наиболее распространёнными простыми веществами являются:
– мышьяк, селен и йод
+ кислород, кремний и водород
– азот, кислород и сера
– фтор, хлор и кислород
5. В 1828 году знаменитый немецкий химик Фридрих Вёлер синтезировал мочевину (органическое вещество) из цианата аммония (неорганического вещества). Это событие показало, что:
– классификация химических элементов зависит от заряда атома
– органические соединения можно получить из чего угодно
+ границы между живой и неживой природами размыты
– неорганические вещества всегда превращаются в органические
6. Одна из приведённых ниже групп веществ принадлежит классификации металлов по физическим свойствам.
– щелочные
+ тугоплавкие
– переходные
– щелочноземельные
7. На картинке изображен:
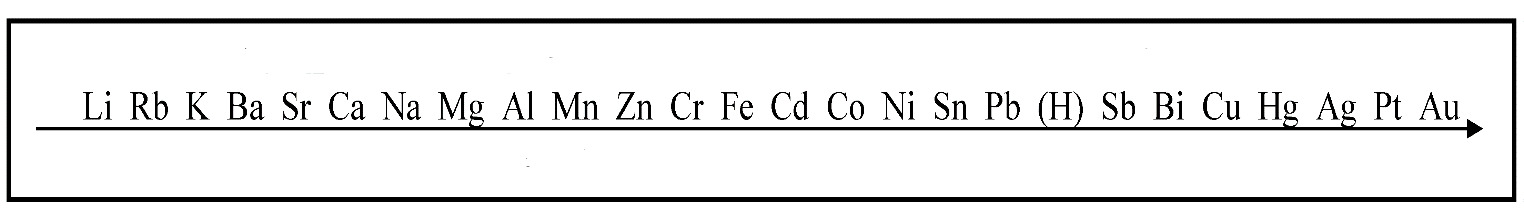
– ряд напряжения неметаллов
– порядок металлов в зависимости от их молекулярной массы
– порядок неметаллов в зависимости от их электроотрицательности
+ ряд активности металлов
8. По сравнению с радиусом атомов металла радиус неметалла:
– больше
– проще
+ меньше
– сложнее
9. Свойства неметаллов и металлов сильно различаются. Какие неметаллы подобно металлам обладают электропроводность?
+ графит, черный фосфор
– кадмий, цезий
– хлор, фтор
– алмаз, темно-красный бром
тест 10. К сложным веществам не относятся:
– оксиды
– основания
+ благородные газы
– кислоты
11. Оксиды – это вещества, состоящие из атомов двух элементов, один из которых обязательно:
+ кислород со степенью окисления -2
– кислород со степенью окисления +2
– азот со степенью окисления -2
– водород со степенью окисления -2
12. Какие вещества образуются при взаимодействии щёлочи и кислотного оксида?
– основной оксид и кислород
– оксид и вода
– соль и металл
+ соль и вода
13. По количеству кислых атомов водорода кислоты не бывают:
– одноосновными
+ бескислородными
– двухосновными
– многоосновными
14. Каким образом получают соли?
– замещением металла на атомы водорода
– путём взаимодействия щелочноземельного металла и воды
+ путём взаимодействия кислоты и основания
– нагреванием нерастворимого основания
15. Условную границу между металлами и неметаллами в Периодической системе химических элементов Менделеева можно провести линией:
– бериллий-радон
– углерод-полоний
+ бор-астат
– литий-лоуренсий
16. Какая из перечисленных характеристик не относится к благородным газам?
– одноатомные (при нормальных условиях)
– не имеют цвета, запаха и вкуса
– не горят и не возгораются (при нормальных условиях)
+ легко вступают в реакцию
17. Несолеобразующие оксиды не вступают в реакцию с щелочами и кислотами и не имеют кислотных гидроксидов. Таким образом, из приведённых ниже оксидов выберите солеобразующий.
– N2O
+ CaO
– CO
– SiO
18. Генетический ряд являет собой цепочку превращений веществ, имеющих в своём составе один и тот же химический элемент. Для неметалла он будет выглядеть:
– неметалл-основный оксид-основание-соль
– металл-неметалл-соль-основание
– неметал-кислота-основание-соль
+ неметалл-кислотный оксид-кислота-соль
19. Как называются вещества, которые в зависимости от условий реакции способны проявлять кислотные или основные свойства?
– промежуточные
+ амфотерные
– двойственные
– адаптивные
тест-20. Внутреннюю среду комплексной соли образуют:
– комплексный ион и связанный с ним противоположный по знаку ион
+ комплексообразователь и ионы или молекулы, которые имеют свободные электронные пары
– комплексный катион и анион
– комплексный анион и катион
21. Что из перечисленного не является тривиальным названием, то есть несоответствующее ни одной номенклатуре?
– алюмоаммонийные квасцы
– неорганический бензол
– плавиковая кислота
+ хлорид тетраамминплатины
22. Некоторые щёлочи способны оставлять серьёзные ожоги на коже и слизистых оболочках, но, тем не менее, они активно используются медицине, производстве моющих средств, удобрений, батареек и т.д. Благодаря каким свойствам они нашли такое широкое применение?
– они слабо растворяются в воде и выделяют тепло
– не способны растворять органические соединения
+ они являются электролитами и хорошо растворимы в воде
– обладают низкой химической активностью
23. В 1778 году французский учёный Антуан Лавуазье выдвинул гипотезу о том, что кислотные свойства обусловлены наличием в составе соединения одного конкретного химического элемента. Гипотеза встретила противоречия, поскольку у некоторых кислот нет в составе этого элемента. Этим элементом был
– водород
+ кислород
– азот
– углерод
24. Соли и их разновидности повсеместно используются в промышленности в качестве сырья и повседневной жизни, например, в кулинарии. Какие соли применяются для производства поваренной соли?
– соли серной кислоты
– соли азотной кислоты
– соли угольной кислоты
+ соли соляной кислоты
25. Лакмус – индикатор кислотно-основных свойств, который применяется для определения реакции среды. В какой пробирке находится щёлочь?

26. Гидриды представляют собой соединения водорода с металлами или неметаллами. По типу химической связи они не бывают:
– ионными
– металлическими
– ковалентными
+ водородными
27. Если элемент-металл проявляет несколько степеней окисления, то:
– его оксид и соль с низшей степенью окисления будут проявлять, как правило, кислотные свойства, с высшей – основные, а с промежуточной – амфотерные
– его соль и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей – кислотные, а с промежуточной – амфотерные
+ его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей – кислотные, а с промежуточной – амфотерные
– его оксиды с низшей степенью окисления будут проявлять, как правило, кислотные свойства, с высшей – основные, а с промежуточной – амфотерные

